气基直接还原炼铁的能耗问题
2020-03-23 作者:佚名 网友评论 0 条
1.北京科技大学冶金与生态工程学院
2.高端金属材料特种熔炼与制备北京市重点实验室
根据世界钢铁协会发布的《世界钢铁统计数据2019》[1],过去三年里,全球直接还原铁产量增长迅猛,2016年全球直接还原铁产量约7590万吨,2017年约8870万吨,2018年约9980万吨,增长率分别为16.86%,12.51%。气基直接还原的工艺,占世界还原铁总产量的80%以上,具有投资少,单体规模大,污染排放低等优势。我国的气基直接还原铁产量虽然当前为零,但是众多企业和科技工作者正在努力开发适用中国条件的工艺和方法。
还原气利用率和综合还原能耗直接关系气基直接还原工艺开发的成败,前者是限定了气体利用限度,后者决定了生产成本的高低。
本文针对气体还原铁氧化物的气体利用率和能耗,从气体还原炼铁的热力学数据出发,建立气体还原的能耗模型,分析了吨金属铁生产所需的还原气量和热能量,对还原气体的选择和搭配、还原铁生产的节能降耗、还原工艺条件的改善都具有一定的参考意义。
1气体还原铁氧化物模型
1.1 单一气体还原铁氧化物
还原气消耗量
根据化学平衡法原理,依据热力学手册数据手册[1],计算单一气体还原铁氧化物的利用率。
已知,当温度大于570℃,Fe2O3的还原分为三个阶段逐级进行,依次为:Fe2O3→Fe3O4,Fe3O4→FeO,FeO→Fe。
表 1列出单一气体还原铁氧化物的化学方程式和相应的热力学函数数值。表中,、,分别式是化学反应在273.15K时标准摩尔熵变、标准摩尔焓变,单位分别为J?K-1?mol-1,kJ?mol-1。还原反应的吉布斯自由能变根据物质标准生成吉布斯自由能求得,然后对开尔文温度T做线性拟合,得到的线性关系式。结合等温方程式,可以求得还原反应的平衡常数。的关系如下式所示:
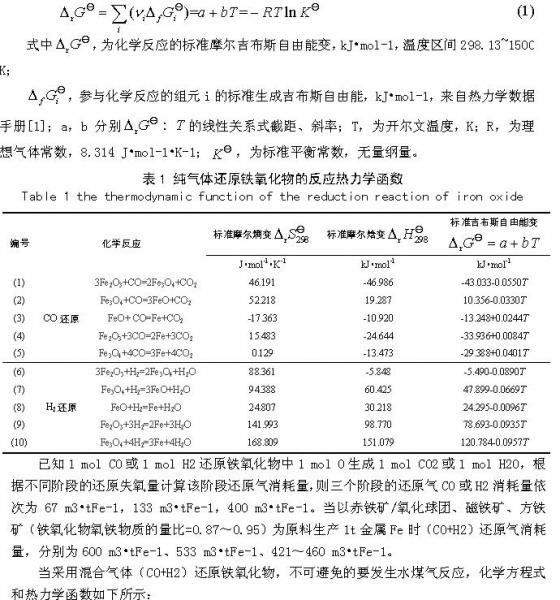

原过程还原气体利用率逐级减小,分别为100%,93.57%~ 96.57%,16.35%~22.54%。温度对于第一级还原反应Fe2O3→Fe3O4的影响几乎没有。温度对于第二级还原反应Fe3O4→FeO的影响比较小,气体利用率在微小上下区间内变化。温度对于第三级还原反应FeO→Fe的影响比较大,气体利用率随温度的变化斜率明显大于第二级还原反应。
另外,对于第二、三级还原反应,CO气体利用率随温度的升高而减小,H2气体利用率随温度的升高而增大。在831~834℃范围时,CO和H2还原相同铁氧化物的气体率相等。高于该温度范围,还原相同铁氧化物的利用率H2高于CO,且随着温度增大,两者的差距也随之变大;低于该温度范围,还原相同铁氧化物的利用率H2低于CO,且随着温度增大,两者的差距随之变小。
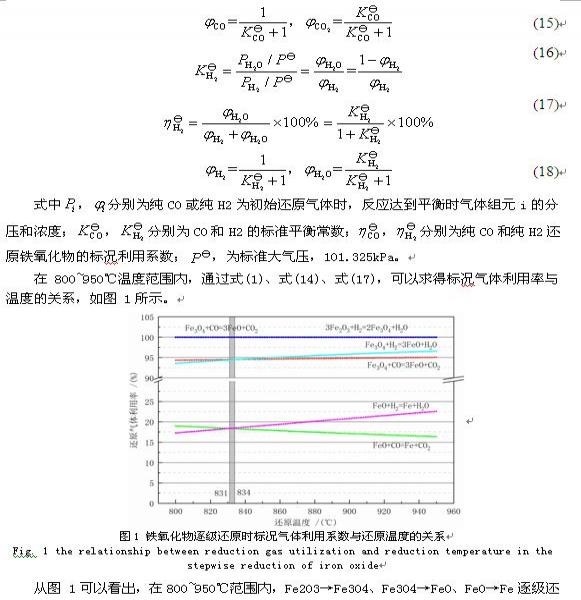
混合气体还原铁氧化物
根据最小自由能原理,依据热力学手册数据手册[1],计算混合气体还原铁氧化物的平衡组成和气体还原气利用率。
1.1.1 最小自由能原理
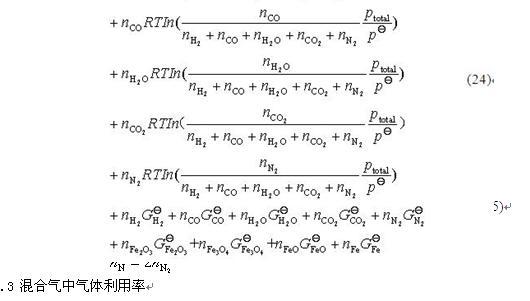
将气基直接还原炼铁过程看作是一个封闭体系,进料为氧化球团矿和还原混合气,出料为金属铁、脉石、尾气,化学反应在高温下充分进行而达到平衡状态。对于这一气固反应的多元多相体系,当体系达到热力学平衡时,总的自由能最小。
最小自由能原理可以从体系中组元的始态和终态的角度来考虑体系的平衡问题,通过初始态,计算平衡态,根据终止态与起始态的物质的量变化,可以判断复杂体系中特定组元的化学反应量。其模型如下式所示,式为约束条件。

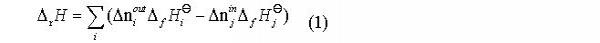

相关文章
[错误报告] [推荐] [收藏] [打印] [关闭] [返回顶部]

 已有
已有